Bismillah,
Ananda yang baik hari ini kita akan melanjutkan Pembelajaran Kimia dengan Bab Baru yaitu konsep Reaksi Reduksi Oksidasi dan Tata nama Senyawa.
Tapi sebelumnya silahkan mengabsen terlebih dahulu pada kolom di bawah ini :
Silahkan Tulis Materi berikut di buku catatan dan bagi yang sudah silahkan fotokan dan Upload di Kumpul Tugas
Konsep Reaksi Reduksi Oksidasi dan Tata Nama Senyawa
Reaksi reduksi oksidasi
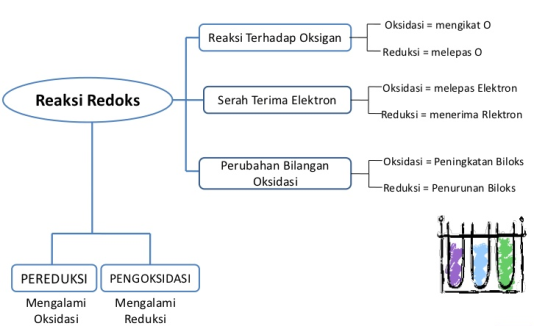
A. Konsep Reaksi Redoks

Reaksi redoks dipandang sebagai hasil dari perpindahan atom oksigen dan hidrogen. Oksidasi merupakan proses terjadinya penangkapan oksigen oleh suatu zat. Sementara itu reduksi adalah proses terjadinya pelepasan oksigen oleh suatu zat. Oksidasi juga diartikan sebagai suatu proses terjadinya pelepasan hidrogen oleh suatu zat dan reduksi adalah suatu proses terjadinya penangkap hidrogen. Seiring dilakukannya berbagai percobaan, konsep redoks juga mengalami perkembangan.
Munculah teori yang lebih modern yang hingga saat ini masih dipakai.
Pada teori ini disebutkan bahwa:
- Oksidasi adalah proses yang menyebabkan hilangnya satu atau lebih elektron dari dalam zat. Zat yang mengalami oksidasi menjadi lebih
- Reduksi adalah proses yang menyebabkan diperolehnya satu atau lebih elektron oleh suatu zat. Zat yang mengalami reduksi akan menjadi lebih Teori ini masih dipakai hingga saat ini. Jadi proses oksidasi dan reduksi tidak hanya dilihat dari penangkapan oksigen dan hidrogen, melainkan dipandang sebagai proses perpindahan elektron dari zat yang satu ke zat yang lain (Arifatun Anifah Setyawati, 2009).
B. Reaksi Redoks berdasarkan Penggabungan dan Pelepasan Oksigen
1. Reaksi Oksidasi
Reaksi oksidasi didefinisikan sebagai reaksi yang terjadi antara suatu zat dan oksigen sehingga membentuk senyawa yang mengandung oksigen. Misalnya (Nana Sutresna, 2007 );
a. Reaksi Pengaratan Besi
Besi (Fe) mula-mula bereaksi dengan oksigen dan uap air menghasilkan senyawa yang mengandung oksigen (Fe2O3. 2H2O) yang disebut karat.
Reaksinya:
4Fe(s) + 3O2(g) → 2Fe2O3(s)
b. Perubahan minyak goreng menjadi tengik. Reaksi ini disebabkan karena asam lemak yang ada pada minyak bereaksi dengan oksigen, sehingga minyak tersebut teroksidasi sehingga berbau tidak enak.
c. Pembakaran; pembakaran kertas, pembakaran lilin, pembakaran minyak tanah, atau elpiji dalam rumah tangga, dan pembakaran glukosa dalam tubuh.
2. Reaksi Reduksi
Reaksi reduksi merupakan kebalikan dari reaksi oksidasi, yaitu reaksi pelepasan oksigen dari suatu zat yang mengandung oksigen. Misalnya (Nana Sutresna, 2007 );
a. Reaksi Fotosintesis
Pada reaksi fotosintesis, tumbuhan menggunakan karbon dioksida, air, dan matahari untuk menghasilkan zat gula dan oksigen. Reaksinya yaitu;
6CO2 + 6H2O → C6H12O6 + 6O2
b. Reaksi pengolahan bijih besi
Bijih besi mengandung atom oksigen (Fe2O3). Untuk memisahkan oksigen dari bijih besi, bijih tersebut direaksikan dengan karbon dan dipanaskan. Sehingga dihasilkan CO2 dan besi murni. Reaksinya yaitu ;
2Fe2O3(s) + 3C(s) → 4Fe(s) + 3CO2(g)
C. Reaksi Redoks berdasarkan Bilangan Oksidasi
Bilangan oksidasi atau tingkat oksidasi merupakan nilai muatan atom dalam suatu molekul atau ion. Biloks atau b.o ini dapat berharga positif atau negatif. Ada atom yang hanya memiliki satu biloks, ada pula yang memiliki lebih dari satu biloks. Prinsip reaksi redoks berdasarkan perubahan biloks terkait dengan pelepasan dan penerimaan elektron dalam suatu reaksi redoks yang menyebabkan perubahan biloks unsur-unsur yang terdapat di dalamnya. Reaksi redoks terjadi jika dalam reaksi tersebut terjadi perubahan bilangan oksidasi.
Reaksi auto redoks atau reaksi disproporsionasi yaitu reaksi yang terjadi jika terdapat satu zat yang mengalami reaksi reduksi sekaligus reaksi oksidasi. Jadi, zat tersebut mengalami penambahan sekaligus pengurangan bilangan oksidasi (Nana Sutresna, 2007 ).
D. Pereduksi dan Pengoksidasi
Partikel akan bersifat pengoksidasi bila ia mempunyai kecenderungan menarik elektron dari partikel lain, yaitu unsur elektronegatif (seperti oksigen, halogen dan H+) dan senyawa yang mengandung unsur elektronegatif (seperti HNO3). Partikel bersifat pereduksi bila mempunyai elektron yang terikat lemah, sehingga mudah lepas dan ditarik oleh partikel lain. Dari sifat periodik unsur diketahui bahwa unsur yang demikian adalah unsur elektropositif atau logam (Syukri S, 1999).
E. Bilangan Oksidasi dan Nama Senyawa
Beberapa unsur transisi dapat membentuk senyawa dengan lebih dari satu bilangan oksidasi. Misalnya besi dapat membentuk dua macam oksida, yaitu fero oksida (FeO) dan feri oksida (Fe2O3). Nama fero diberikan pada besi dengan bilangan oksidasi rendah (+2) dan feri diberikan pada besi dengan bilangan oksidasi tinggi (+3). Permasalahan yang timbul adalah untuk logam yang dapat membentuk senyawa dengan lebih dari dua bilangan oksidasi. Oleh karena itu, IUPAC membuat aturan tata nama dengan menunjukkan bilangan oksidasinya. Caranya dengan menambahkan angka romawi dalam tanda kurung. Sebagai contoh, besi mempunyai dua bilangan oksidasi, yaitu +2 dan +3 yang disebut sebagai besi (II) dan besi (III), sehingga nama untuk FeO adalah besi (II) oksida dan Fe2O3 adalah besi (III) oksida (Unggul Sudarmo, 2013).
Tata Nama Senyawa
Setiap senyawa perlu mempunyai nama spesifik. Seperti halnya penamaa unsur, pada mulanya penamaan senyawa didasarkan pada berbagai hal, seperti nama tempat, nama orang, atau sifat tertentu dari senyawa yang bersangkutan.
Dewasa ini, jutaan senyawa telah dikenal dan tiap tahun ditemukan ribuan senyawa baru, sehingga diperlukan cara untuk pemberian nama. Oleh karena itu mustahil bagi kita untuk menghapalkan jutaan nama dan setiap nama berdiri sendiri, tanpa kaitan antara yang satu dengan yang lainnya. Dalam sistem penamaan yang digunakan sekarang, nama senyawa didasarkan pada rumus kimianya. Kita akan membahas cara penamaan senyawa yang terdiri dari dua dan tiga jenis unsur.
Tata nama Senyawa Anorganik
Tata Nama Senyawa Anorganik yang dipelajari pada pokok bahasan ini adalah:
- Tata nama senyawa Biner
- Tata nama senyawa Ion
- Tata nama senyawa Terner
A. Tata nama senyawa biner
1. Logam + Non Logam
a. Penaman senyawa biner mengikuti urutan berikut :
Bi – Si – As – C – P – N – H – S – I – Br – Cl – O – T
b. Tuliskan nama unsur logam tanpa modifikasi apa pun, kemudian diikuti nama unsur non logam dengan akhiran “ida”.
Contoh : NaCl = Natrium klorida
c. Unsur – unsur logam dengan bilangan oksidasi lebih dari satu jenis, maka bilangan oksidasinya ditulis dengan angka romawi.
Contoh : CrO = Kromium (II) oksida
2. Non Logam + Non Logam
a. Satu Jenis Senyawa
Cara penulisan rumus dan senyawanya yaitu dengan menuliskan terlebih dahulu unsur dengan bilangan oksidasi positif baru kemudian diikuti unsur dengan bilangan oksidasi negatif + ida.
Contoh : HCl = Hidrogen klorida
H2S = Hidrogen sulfida
b. Lebih dari Satu Jenis Senyawa
Cara penulisan rumus dan senyawanya yaitu dengan menuliskan terlebih dahulu unsur dengan bilangan oksidasi positif diikuti unsur dengan awalan mono / di / tri…../ deka dan akhiran “ida”.
Contoh : CO2 = Karbon dioksida
NO2 = Nitrogen dioksida
B. Tata Nama Senyawa Ion
Senyawa ion terdiri atas suatu kation dan suatu anion. Kation umumnya adalah ion logam sedangkan anion dapat berupa anion non logam. Berikut ini beberapa contoh senyawa ion.
Kation | Anion | Rumus Senyawa Ion |
Na+ | Cl– | NaCl |
K+ | OH– | KOH |
Na+ | SO42- | Na2SO4 |
Beberapa Jenis Kation
No | Rumus | Nama ion |
1. | Na+ | Natrium |
2. | K+ | Kalium |
3. | Mg2+ | Magnesium |
4. | Ca2+ | Kalsium |
5. | Ba2+ | Barium |
Beberapa Jenis Anion
No | Rumus | Nama ion |
1 | OH– | Hidroksida |
2 | O2- | Oksida |
3 | F– | Fluorida |
4 | Cl– | Klorida |
5 | PO43- | Fosfat |
C. Tata Nama Senyawa Terner
Senyawa terner sederhana meliputi asam, basa, dan garam. Asam, basa, dan garam adalah tiga kelompok senyawa yang paling terkait satu dengan yang lain. Reaksi asam dengan basa menghasilkan garam.
1. Tata Nama Asam
Rumus asam terdiri atas atom hidrogen dan suatu anion yang di sebut sisa asam. Akan tetapi perlu diingat bahwa asam adalah senyawa molekul, bukan senyawa ion.
Contoh : H3PO4
Nama asam : asam fosfat
Rumus sisa asam : PO43-
2. Tata Nama Basa
Basa adalah zat yang didalam air dapat menghasilkan ion OH–. Pada umumnya basa adalah senyawa ion yang terdiri dari kation logam dan anion OH–. Nama basa sama dengan nama kationnya yang diikuti kata hidroksida.
Contoh : NaOH (Natrium Hidroksida)
Ca(OH)2 (Kalsium Hidroksida)
3. Tata Nama Garam
Garam adalah senyawa ion yang terdiri dari kation basa dan anion sisa asam. Rumus dan penamaannya sama dengan senyawa ion.
Kation | Anion | Rumus Garam | Nama Garam |
Na+ | NO3– | NaNo3 | Natrium Nitrat |
Ca2+ | NO3– | Ca(NO3)2 | Kalsium Nitrat |
Al3+ | SO4– | Al2(SO4)3 | Aluminium Sulfat |
Cu2+ | S2- | CuS | Tembaga (II) sulfida |
Tata Nama Senyawa Organik
Senyawa organik adalah senyawa – senyawa karbon dengan sifat – sifat tertentu. Senyawa organik mempunyai tata nama khusus. Selain nama sistematis, banyak senyawa organik mempunyai nama lazim atau nama dagang.
Beberapa di antaranya berikut ini :
- CH4
- CO(NH2)2
- CH3COOH
- C6H12O6
- C12H22O11
Jumlah senyawa organik sangat banyak dan tata nama senyawa organnik lebih kompleks karena tidak dapat ditentukan dari rumus kimianya saja tetapi dari rumus struktur dan gugus fungsinya. Disini hanya dibahas tata nama senyawa organik yang sederhana saja.

